Padres de familia........... Pitos y flautas .......................
Que paso con el acompañamiento al proceso de nivelación?
Los que asistieron no cumplieron con lo esperado..................
y por qué no asistieron todos los niños citados?
CLASE DEL 18 DE NOVIEMBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
CLASE DEL 12 DE NOVIEMBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
Ej:
+3
Au + O2 _____ Au2 O3
Au2 O3 + H2O _________ Au(OH)3
Ahora elabora los hidróxidos de:
+4
Pb
+1
Hg
+4
Sn
+2
Co
+3
Ni
+7
Mn
+1
Cu
+6
Cr
Consulta el nombre, formula y usos a los siguientes hidróxidos que llevan nombres comunes o vulgares como:
Acompaña la consulta de imágenes de cada compuesto.
Para Resolver en Clase:
1°Ingresar al siguiente link y resolver los ejercicios alli propuestos:
http://www.alonsoformula.com/inorganica/hnomes_1.htm
2° Completar la siguiente tabla:
CLASE DEL 05 DE NOVIEMBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
En Casa:
Ingresa al siguiente link y prepárate para la evaluación del tema óxidos:
http://www.eis.uva.es/~qgintro/genera.php?tema=1&ejer=3
Resolver la siguiente actividad:
CLASE DEL 29 DE OCTUBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
En Clase:
Explicación de la nomenclatura tradicional para óxidos.
Organizados en grupos de dos estudiantes resolver el taller evaluativo de óxidos.
CLASE DEL 22 DE OCTUBRE DE 2015
Nombra (empleando la nomenclatura sistemática y stock):
Li2O, Cu2O, Cr2O3, Al2O3, SiO2, N2O, FeO, MgO, CaO, PbO,
Formula los siguientes óxidos:
Óxido de nitrógeno (III), Óxido de cloro (V), Óxido de estaño (IV), Óxido de nitrógeno (V), Óxido de fósforo (III), Trióxido de Azufre, Pentaóxido de dicloro, Monóxido de cloro, Monóxido de cobalto y dióxido de carbono.
En clase:
Laboratorio: Indicador casero
Observa de nuevo el vídeo ingresando al siguiente link, para que recuerdes aspectos importantes de la preparación del indicador y la escala del PH:
https://www.youtube.com/watch?v=TJQDGepMnSU
Para ello reúne en grupos de 3 estudiantes el siguiente material y llévalo sin falta para la clase, no olvides la bata, guantes, tapabocas y gafas, ya que sin ellos sera imposible participar de la práctica. Recuerda que tu vales mucho.
Indicador casero preparado: 1 litro (recuerda que se prepara cocinando hojas de col morada, observa de nuevo el vídeo). Llévalo en una botella plástica.
10 vasos desechables trasparentes
Bicarbonato de sodio
Agua destilada
Vinagre
Jugo de limón
Jugo de naranja
Jugo de tomate
Café
Sal
Leche de magnesia
Jabón líquido
Recuerda llevar en pequeña cantidad estos materiales.
De igual manera lleva medio pliego de cartulina y colores para elaborar la escala del PH. En ella registraremos:
Estudia para la evaluación de los números de oxidación. Recuerda que estos números obedecen al grupo al cual pertenezca el elemento, por ello puedes repasar los grupos A de la Tabla Periódica y aprenderás con facilidad el tema.
CLASE DEL 15 DE OCTUBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
En Casa:
Estudiar para evaluación escrita el tema de formulación y clases de óxidos.
Estudiar los números de oxidación teniendo en cuenta la siguiente tabla:
En Clase:
Que paso con el acompañamiento al proceso de nivelación?
Los que asistieron no cumplieron con lo esperado..................
y por qué no asistieron todos los niños citados?
CLASE DEL 18 DE NOVIEMBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
Clase:
Actividades de nivelación: De 2:00 pm a 4:00 p.m
Favor llevar diligenciado y estudiado el taller de nivelación, entregado el pasado 12 de noviembre.
No olvides llevar el cartel ecológico teniendo en cuenta las sugerencias dadas en clase.
Espero realices estas actividades con dedicación.
Hola mis queridos estudiantes.
Actividades para realizar:
En Casa:
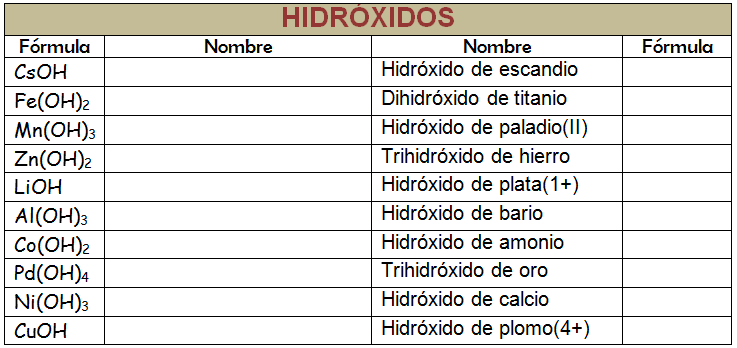
Teniendo en cuenta lo explicado en clase, formula los hidróxidos a los siguientes elementos:Ej:
+3
Au + O2 _____ Au2 O3
Au2 O3 + H2O _________ Au(OH)3
Ahora elabora los hidróxidos de:
+4
Pb
+1
Hg
+4
Sn
Cr
Consulta el nombre, formula y usos a los siguientes hidróxidos que llevan nombres comunes o vulgares como:
soda caústica
potasa caústica
cal apagada, lechada de cal
Leche de magnesia
Alumbre
Alumbre
Acompaña la consulta de imágenes de cada compuesto.
Para Resolver en Clase:
1°Ingresar al siguiente link y resolver los ejercicios alli propuestos:
http://www.alonsoformula.com/inorganica/hnomes_1.htm
2° Completar la siguiente tabla:
3° Nombre
los siguientes compuestos:
a.
Sr(OH)2
b.
Ni(OH)2
c.
Al(OH)3
d.
Pt(OH)4
e. NaOH
f. Ca(OH)2
g. Au(OH)3
h.
RbOH
i.
Cd(OH)2
j.
Sn(OH)4
4 Completar
la siguiente tabla
Fórmula
química del hidróxido
|
Fórmula
química del óxido del que se formó
|
N.
Sistemática
Hidróxido
|
N.
Tradicional Hidróxido
|
N.
Stock Hidróxido
|
Sr(OH)2
|
||||
Trihidróxido de
Indio
|
||||
TiO2
|
||||
Hidróxido
platinoso
|
||||
Hidróxido
de mercurio (II)
|
I. CON BASE EN LA INFORMACION CONTENIDA EN LA REJILLA, COMPLETA LOS ENUNCIADOS PROPUESTOS
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
| ||||||||
Zn(OH)2
|
Cr(OH)6
|
PtO
|
Cu+1
|
PtO2
|
H2O
|
Sr(OH)2
|
Fe2O3
| ||||||||
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
| ||||||||
Cd(OH)2
|
Pt(OH)4
|
KOH
|
OH-1
|
Fe(OH)3
|
Cu+2
|
Pt(OH)2
|
Cr(OH)3
| ||||||||
A. Son ejemplos de la función ____________________ los compuestos de las casillas 10 y 7, los cuales se denominan respectivamente _______________________________________________________ y _______________________________________________________
B. Los compuestos de las casillas 1 y 9, se denominan respectivamente ___________________________________________ y ___________________________________________
C. El compuesto de la casilla 13, denominado _____________________________________________ , se forma a partir de la reacción de los compuestos de las casillas ______ y ______ , denominados ______________________ y ______________________ , respectivamente.
D. El hidróxido cromoso se encuentra en la casilla ______ , mientras que el hidróxido de potasio se encuentra en la casilla ______.
E. La fórmula del hidróxido de cobre (II) se obtiene al combinar los contenidos de las casillas ______ y ______ , respectivamente.
F. El dihidróxido de platino, ubicado en la casilla ______ , se obtiene cuando reaccionan los compuestos de las casillas ______ y ______ , denominados ______________________ y ______________________ , respectivamente.
II. ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTO O INCORRECTO EL NOMBRE ASIGNADO AL COMPUESTO DADO. EN CASO DE SER INCORRECTO, ESCRIBE EN EL RESPECTIVO ESPACIO EL NOMBRE CORRECTO
A. AgOH monohidróxido de plata ( ) ___________________________________
B. LiOH Monohidróxido de monolitio ( ) ___________________________________
C. Al(OH)3 Hidróxido aluminoso ( ) ___________________________________
D. Au(OH)3 Hidróxido auroso ( ) ___________________________________
E. Hg(OH)2 Hidróxido mercurioso ( ) ___________________________________
F. Os(OH)8 Hidróxido de osmio ( ) ___________________________________
G. Pb(OH)2 Hidróxido de plomo (II) ( ) ___________________________________
H. Cu(OH)2 Hidróxido de cobre ( ) ___________________________________
III. ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTA O INCORRECTA LA FORMULA ASIGNADA AL NOMBRE DADO. EN CASO DE SER INCORRECTA, ESCRIBE EN EL RESPECTIVO ESPACIO LA FORMULA CORRECTA
A. Hidróxido de plata Ag(OH)2 ( ) ___________________________________
B. Hidróxido paládico Pd(OH)2 ( ) ___________________________________
C. Tetrahidróxido de estaño S(OH)4 ( ) ___________________________________
D. Hidróxido plumboso Pb(OH)2 ( ) ___________________________________
E. Hidróxido de níquel (III) Ni(OH)3 ( ) ___________________________________
F. Hidróxido de osmio (IV) Os4OH ( ) ___________________________________
G. Hidróxido de indio I(OH)3 ( ) ___________________________________
H. Hidróxido cobaltoso Co(OH)3 ( ) ___________________________________
IV. COMPLETA EL SIGUIENTE CUADRO
Fórmula
|
N. Sistemático
|
N. Stock
|
N. Tradicional
|
Sn(OH)2
| |||
Dihidróxido de hierro
| |||
Hidróxido de talio (I)
| |||
Hidróxido cuproso
| |||
NaOH
| |||
Dihidróxido de níquel
| |||
Hidróxido de mercurio (II)
| |||
Hidróxido ferrico
|
NOTA.
A continuación relaciono las actividades de nivelación para los desempeños bajos y básicos alcanzados hasta la fecha por los estudiantes, para ser presentados y evaluados sin falta para el 18-11-15
ACTIVIDAD DE RECUPERACIÓN DE QUÍMICA – 4° Período
1.
¿Cómo
se forma un Óxido?
2.
Escriba
la ecuación de formación de un óxido.
3.
¿Qué
es un óxido básico?
4.
Escriba
la fórmula de 5 óxidos básicos.
5.
¿Qué
es un óxido ácido?
6.
Escriba
la fórmula de 5 óxidos ácidos.
7.
Clasifique
como ácidos o básicos los siguientes óxidos y asígneles el nombre en los 3
sistemas de nomenclatura estudiados en clase.
a.
CuO
b.
Cl2O3
c.
AuO
d.
PbO2
e.
HgO
f.
N2O5
8.
¿Cómo
se forma un Hidróxido?
9.
Escriba
la ecuación de formación o reacción general de un hidróxido.
10.
Dé
el nombre a los siguientes hidróxidos en los 3 sistemas de nomenclatura
estudiados en clase.
a.
Fe(OH)3
b.
Cu(OH)2
c.
Mg(OH)2
d.
Cr(OH)6
e.
KOH
f.
Pt(OH)4
11.
Escriba
la fórmula de los siguiente compuestos:
a.
Óxido
de litio.
b.
Hidróxido
áurico.
c.
Hidróxido
de bario.
d.
Óxido
de plomo (IV).
e.
Hidróxido
de cobre (II).
f.
Óxido
nitroso.
12.
Complete y balancee las
siguientes ecuaciones químicas:
a.
Al2O3 + ? H2O →
b.
BaO + ? H2O →
c.
PbO2
+ ? H2O
→
d.
Cu2O + ? H2O
→
13.
Complete las siguientes ecuaciones con el nombre del hidróxido
formado:
a.
Oxido ferroso + agua
→
b.
Oxido de aluminio + agua →
c.
Trióxido de azufre + agua →
d.
Oxido estánico + agua →
ACTIVIADES DE
RECUPERACIÓN DE QUÍMICA CUARTO PERIODO
TALLER: Nomenclatura
Inorgánica (Óxidos 1)
I.
CON
BASE EN LA INFORMACION CONTENIDA EN LA REJILLA, COMPLETA LOS ENUNCIADOS
PROPUESTOS
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
||||||||
ZnO
|
Sn+4
|
MgO
|
Hg2O
|
O-2
|
H2O
|
OsO4
|
O2
|
||||||||
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
||||||||
SnO2
|
Cl2O7
|
ZnO
|
OH-1
|
In
|
Fe2O3
|
In2O3
|
Sn+2
|
||||||||
A. Son
ejemplos de la función ____________________ los compuestos de las casillas 14 y
4, los cuales se denominan respectivamente
_______________________________________________________ y _______________________________________________________
B. Los
compuestos de las casillas 3 y 15, se denominan respectivamente ___________________________________________ y
___________________________________________
C. El
compuesto de la casilla 15, denominado _____________________________________________
, se forma a partir de la reacción de los elementos de las casillas ______ y ______
, denominados ______________________ y ______________________ ,
respectivamente.
D. El
compuesto de la casilla ______ , denominado ________________________________________
, se clasifica como un óxido ácido; mientras
que el de la casilla ______ , denominado _____________________________________________
, se clasifica como un óxido básico.
E. Si
se combinan los iones de las casillas 2 y 5 se obtiene el compuesto de la
casilla ______ , denominado _____________________________________________
F. El
compuesto de la casilla 10, se denomina
_____________________________________________, mientras que el de la casilla 7,
se denomina _____________________________________________.
II.
ESCRIBE
EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTO O INCORRECTO EL NOMBRE ASIGNADO
AL COMPUESTO DADO. EN CASO DE SER
INCORRECTO, ESCRIBE EN EL RESPECTIVO ESPACIO EL NOMBRE CORRECTO
A. Y203
Dióxido de triitrio ( ) ___________________________________
B. Au2O Óxido áurico ( ) ___________________________________
C. Br2O3 Óxido bromoso ( ) ___________________________________
D. BaO Hidróxido de bario (II) ( ) ___________________________________
E. MnO3 Óxido de manganeso (III) (
) ___________________________________
F. CrO3 Óxido de cromo ( ) ___________________________________
G. Li2O Dióxido de litio ( ) ___________________________________
H. HgO Óxido de mercúrico ( ) ___________________________________
III.
ESCRIBE
EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTA O INCORRECTA LA FORMULA ASIGNADA
AL NOMBRE DADO. EN CASO DE SER
INCORRECTA, ESCRIBE EN EL RESPECTIVO ESPACIO LA FORMULA CORRECTA
A. Óxido
de rubidio Rb2O ( ) ___________________________________
B. Óxido
circónico ZrO2 ( ) ___________________________________
C. Pentóxido
de dinitrógeno N5O2 ( ) ___________________________________
D. Óxido
plúmbico Pb4O ( ) ___________________________________
E. Óxido
de azufre (IV) SO3 ( ) ___________________________________
F. Óxido
de platino (IV) PtO4 ( ) ___________________________________
G. Óxido
brómico B2O3 ( ) ___________________________________
H. Óxido
de plata AgO2 ( ) ___________________________________
IV.
COMPLETA
EL SIGUIENTE CUADRO
Fórmula
|
N. Sistemático
|
N. Stock
|
N. Tradicional
|
I2O5
|
|||
Dióxido
de silicio
|
|||
Óxido
de manganeso (VII)
|
|||
Óxido
plumboso
|
|||
SnO
|
|||
Trióxido
de diníquel
|
|||
Óxido
de platino (II)
|
|||
Óxido
cúprico
|
ACTIVIADES DE
RECUPERACIÓN DE QUÍMICA CUARTO PERIODO
TALLER: Nomenclatura
Inorgánica (Óxidos 2)
I.
ESCRIBE
EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTO O INCORRECTO EL NOMBRE ASIGNADO
AL COMPUESTO DADO. EN CASO DE SER
INCORRECTO, ESCRIBE EN EL RESPECTIVO ESPACIO EL NOMBRE CORRECTO
A. OsO4 Óxido de osmio (IV) ( ) ___________________________________
B. SeO3 Óxido de selenio ( ) ___________________________________
C. I2O5
Óxido yódico ( ) ___________________________________
D. HgO Óxido de mercurio ( ) ___________________________________
E. Li2O Dióxido de litio ( ) ___________________________________
II.
ESCRIBE
EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTA O INCORRECTA LA FORMULA ASIGNADA
AL NOMBRE DADO. EN CASO DE SER
INCORRECTA, ESCRIBE EN EL RESPECTIVO ESPACIO LA FORMULA CORRECTA
A. Óxido
de plata AgO2 ( ) ___________________________________
B. Óxido
circónico ZrO2 ( ) ___________________________________
C. Óxido
de nitrógeno (I) NO2 ( ) ___________________________________
D. Pentóxido
de difósforo P5O2 ( ) ___________________________________
E. Óxido
perclórico Cl2O5 ( ) ___________________________________
III.
COMPLETA
EL SIGUIENTE CUADRO
Fórmula
|
N. Sistemático
|
N. Stock
|
N. Tradicional
|
SnO
|
|||
Monóxido
de bario
|
|||
Óxido
de carbono (II)
|
|||
Óxido
antimónico
|
IV.
RESPONDE
EL SIGUIENTE CUESTIONARIO SOBRE NOMENCLATURA DE ÓXIDOS
PREGUNTAS
DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO I)
1. El nombre tradicional para el compuesto Ga2O3 es:
A.
Trióxido
de digalio
B.
Óxido
gálico
C.
Óxido
de galio
D.
Óxido
de galio (I)
2. La fórmula para el óxido yodoso es:
A.
I2O3 C. Y2O7
B.
Y2O5 D. I2O5
3. El compuesto de fórmula Co2O3 tiene como nombre
tradicional:
A.
Óxido
de cobalto
B.
Óxido
cobaltoso
C.
Óxido
cobaltico
D.
No
tiene nomenclatura tradicional
4.
La fórmula del óxido de nitrógeno
(IV), es:
A.
Ni2O3 C. NiO2
B.
NO2 D. N2O4
5. El nombre stock para el compuesto CrO3 , es:
A.
Óxido
de cromo
B.
Óxido
de cromo (VI)
C.
Óxido
crómico (III)
D.
Óxido
de cromo (III)
6.
La fórmula para el óxido de potasio,
es:
A.
P2O C. PoO
B.
CaO D. K2O
ACTIVIADES DE
RECUPERACIÓN DE QUÍMICA CUARTO PERIODO
TALLER: Nomenclatura
Inorgánica (Hidróxidos 2)
I.
ESCRIBE
EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTO O INCORRECTO EL NOMBRE ASIGNADO
AL COMPUESTO DADO. EN CASO DE SER
INCORRECTO, ESCRIBE EN EL RESPECTIVO ESPACIO EL NOMBRE CORRECTO
A. LiOH Hidróxido de litio (I) ( ) ___________________________________
B. Zr(OH)4 Dihidróxido circónico ( ) ___________________________________
C. Co(OH)2
Hidróxido cobaltoso ( ) ___________________________________
D. HgOH Hidróxido de mercurio ( ) ___________________________________
E. Al(OH)3 Hidróxido alumínico ( ) ___________________________________
II.
ESCRIBE
EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTA O INCORRECTA LA FORMULA ASIGNADA
AL NOMBRE DADO. EN CASO DE SER
INCORRECTA, ESCRIBE EN EL RESPECTIVO ESPACIO LA FORMULA CORRECTA
A. Dihidróxido
de estaño Sn(OH)2 ( ) ___________________________________
B. Hidróxido
férrico Fe(OH)2 ( ) ___________________________________
C. Hidróxido
de calcio CaOH ( ) ___________________________________
D. Monohidróxido
de potasio POH ( ) ___________________________________
E. Hidróxido
de nique (III) Ni3OH ( ) ___________________________________
III.
COMPLETA
EL SIGUIENTE CUADRO
Fórmula
|
N. Sistemático
|
N. Stock
|
N. Tradicional
|
NaOH
|
|||
Dihidróxido
de berilio
|
|||
Hidróxido
de plomo (IV)
|
|||
Hidróxido
auroso
|
IV.
RESPONDE
EL SIGUIENTE CUESTIONARIO SOBRE NOMENCLATURA DE HIDRÓXIDOS
PREGUNTAS
DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO I)
1.
La
fórmula del hidróxido estánnico es:
A.
Es(OH)2 C.
SnOH
B.
Sn(OH)4 D.
EsOH
2.
En sistema tradicional, el
compuesto RbOH se denomina:
A.
Hidróxido
de rubidio
B.
Hidróxido
de rubidio (I)
C.
Monohidróxido
de rubidio
D.
Hidróxido
rubídico
3.
El nombre
stock para el compuesto Pd(OH)2 es:
A.
Hidróxido
de platino (II)
B.
Hidróxido
de plomo (IV)
C.
Hidróxido
de paladio (II)
D.
No
tiene nomenclatura stock
4.
El tetrahidróxido de platino presenta
como fórmula:
A.
Pb(OH)4 C.
Pt(OH)4
B.
Ag(OH)4 D.
Pd(OH)4
5.
El compuesto de fórmula Os(OH)4
tiene como nombre stock:
A.
Hidróxido
de Osmio (IV)
B.
Hidróxido
ósmico (IV)
C.
Tetrahidróxido
de osmio (IV)
D.
No
tiene nomenclatura stock
6.
El nombre tradicional para el
compuesto Zn(OH)2 es:
A.
Hidróxido
circónico
B.
Dihidróxido
de zinc
C.
Hidróxido
de zinc
D.
Hidróxido
circonioso
Hola mis queridos estudiantes.
Actividades para realizar:
En Casa:
Complete solo la nomenclatura tradicional a los siguientes compuestos:
COMPUESTO
|
NOMENCLATURA STOCK
|
NOMENCLATURA
SISTEMATICA
|
NOMENCLATURA
TRADICIONAL
|
P2O3
|
|||
Cl2O7
|
|||
Son
|
|||
NiO
|
|||
FeO
|
|||
Fe2O3
|
|||
Cu2O
|
|||
CuO
|
|||
CO2
|
|||
Al2O3
|
|||
Hg2O
|
|||
CaO
|
|||
Cl2O5
|
|||
P2O5
|
|||
Na2O
|
|||
PbO2
|
|||
Br2O
|
|||
ZnO
|
|||
SrO
|
|||
K2O
|
|||
N2O3
|
|||
N2O5
|
|||
Br2O5
|
|||
Br2O3
|
|||
Cl2O5
|
|||
SO2
|
|||
SO3
|
|||
CO
|
Ingresa al siguiente link y prepárate para la evaluación del tema óxidos:
http://www.eis.uva.es/~qgintro/genera.php?tema=1&ejer=3
Relaciona las siguientes columnas.
NOMBRE
|
FÓRMULAS
|
|
( ) Cl2O5
|
|
( ) P2O3
|
|
( ) Al2O3
|
|
( ) SO
|
|
( ) Cs2O
|
|
( ) PbO2
|
|
( ) SnO2
|
Proyecto transversal:
Ingresa al siguiente link y observa la película Water wold y participa en clase resolviendo las preguntas propuestas por la docente. Deja tu comentario en el blog ya que se valorará en la planilla de calificaciones.
En Clase:
Evaluación oral y escrita del tema formulación y nomenclatura de óxidos. Ingresa al siguiente link y prepárate:
CLASE DEL 29 DE OCTUBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
En Clase:
Explicación de la nomenclatura tradicional para óxidos.
Organizados en grupos de dos estudiantes resolver el taller evaluativo de óxidos.
CLASE DEL 22 DE OCTUBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
En Casa:
Actividades para realizar:
En Casa:
Nombra (empleando la nomenclatura sistemática y stock):
Li2O, Cu2O, Cr2O3, Al2O3, SiO2, N2O, FeO, MgO, CaO, PbO,
Formula los siguientes óxidos:
Óxido de nitrógeno (III), Óxido de cloro (V), Óxido de estaño (IV), Óxido de nitrógeno (V), Óxido de fósforo (III), Trióxido de Azufre, Pentaóxido de dicloro, Monóxido de cloro, Monóxido de cobalto y dióxido de carbono.
En clase:
Laboratorio: Indicador casero
Observa de nuevo el vídeo ingresando al siguiente link, para que recuerdes aspectos importantes de la preparación del indicador y la escala del PH:
https://www.youtube.com/watch?v=TJQDGepMnSU
Para ello reúne en grupos de 3 estudiantes el siguiente material y llévalo sin falta para la clase, no olvides la bata, guantes, tapabocas y gafas, ya que sin ellos sera imposible participar de la práctica. Recuerda que tu vales mucho.
Indicador casero preparado: 1 litro (recuerda que se prepara cocinando hojas de col morada, observa de nuevo el vídeo). Llévalo en una botella plástica.
10 vasos desechables trasparentes
Bicarbonato de sodio
Agua destilada
Vinagre
Jugo de limón
Jugo de naranja
Jugo de tomate
Café
Sal
Leche de magnesia
Jabón líquido
Recuerda llevar en pequeña cantidad estos materiales.
De igual manera lleva medio pliego de cartulina y colores para elaborar la escala del PH. En ella registraremos:
Sustancia
|
Color
|
PH
|
Estudia para la evaluación de los números de oxidación. Recuerda que estos números obedecen al grupo al cual pertenezca el elemento, por ello puedes repasar los grupos A de la Tabla Periódica y aprenderás con facilidad el tema.
CLASE DEL 15 DE OCTUBRE DE 2015
Hola mis queridos estudiantes.
Actividades para realizar:
En Casa:
Estudiar para evaluación escrita el tema de formulación y clases de óxidos.
Estudiar los números de oxidación teniendo en cuenta la siguiente tabla:
En Clase:
Explicación de tipos de Nomenclatura:
Nomenclaturas de los óxidos básicos:
• En la nomenclatura tradicional o clásica,
se utiliza el nombre genérico óxido seguido del nombre del metal terminado en
el sufijo oso para la menor valencia, o de lo contrario el sufijo ico
para la mayor valencia. Cuando poseen una sola valencia también se puede
emplear el sufijo ico.
• En la nomenclatura stock, si el metal posee 2 o
más valencias, éstas se indican mediante números romanos, y si el metal posee 1
sola valencia entonces se omite el número romano.
Ejemplos:
Formulación
|
Fórmula
|
N. tradicional
|
N. stock
|
Fe+3 + O-2
|
Fe2O3
|
óxido férrico
|
óxido de hierro (III)
|
Pb+4 + O-2
|
PbO2
|
óxido plúmbico
|
óxido de plomo (IV)
|
Au+1 + O-2
|
Au2O
|
óxido auroso
|
óxido de oro (I)
|
Sn+2 + O-2
|
SnO
|
óxido estañoso
|
óxido de estaño (III)
|
Al+3 + O-2
|
Al2O3
|
óxido de aluminio (ico)
|
óxido de aluminio *
|
* Debe recordarse que el aluminio tiene valencia
única.
Algunos óxidos poseen nombres comunes o vulgares,
muchos de los cuales tienen origen geológico, es decir derivan del estudio de
los minerales; otros son nombres comerciales.
Ejemplos:
·
CaO : cal viva
·
Fe2O3 :
hematita
·
MnO2 : pirolusita
·
BaO : barita
·
SnO2 : casiterita
·
ZnO : cincita
·
MgO : magnesia
·
Al2O3 :
alúmina , corindón
Óxidos ácidos o
anhídridos
Son óxidos formados por la combinación del oxígeno
con elementos no metálicos, aunque también se encuentra en esta categoría
algunos óxidos de metales que son anfóteros como el vanadio, cromo y manganeso.
En la nomenclatura tradicional se denomina anhídrido
(quiere decir sin H2O) que es el nombre genérico, seguido del nombre
del elemento con un prefijo y/o sufijo, dependiendo de la valencia con que
actúe. El siguiente cuadro nos muestra la nomenclatura de estos óxidos, según
la valencia del no metal.
Ejemplos:
1. El boro posee una sola valencia
igual a 3
B3O2- → B2O3
Oxido Bórico
2. El carbono posee dos valencias:
2 y 4
C2O2- → CO, Oxido carbonoso
C4O2- → CO2, Oxido
carbónico
3. El cloro posee 4 valencias (1,
3, 5, 7)
Cl1O2- → Cl2O, Oxido
hipocloroso
Cl3O2- → Cl2O3,
Oxido cloroso
Cl5O2- → Cl2O5,
Oxido clórico
Cl7O2- → Cl2O7,
Oxido Perclórico
Para óxidos ácidos, la IUPAC recomienda el uso de
nomenclatura sistemática y no la nomenclatura de stock.
Ejemplos:
Fórmula
|
N. sistemática
|
N. stock (no recomendable)
|
V2O5
|
pentóxido de di vanadio
|
óxido de vanadio (V)
|
TeO3
|
trióxido de teluro
|
óxido de teluro (III)
|
Cl2O7
|
heptóxido de di cloro
|
óxido de cloro (VII)
|
CO
|
monóxido de carbono
|
óxido de carbono (II)
|
I2O3
|
trióxido de di yodo
|
óxido de yodo (III)
|
Nombrar los óxidos formulados en clase.
Clase del 01 -10-15
Hola mis queridos estudiantes:
ACTIVIDADES PARA REALIZAR EN CASA:
1° Identifica en la siguiente lista de fórmulas los que son óxidos básicos y los que son óxidos ácidos: Escribe O.B u O.A
Ag2O
Al2O3
Au2O
B2O3
BaO
BeO
Bi2O3
Bi2O5
Br2O3
CaO
Cl2O5
CO
Cr2O3
CrO3
Cu2O
Fe2O3
Hg2O
I2O7
K2O
Li2O
Mn2O7
MnO
N2O5
Na2O
Ni2O3
P2O3
PbO2
SnO
SO3
ZnO
2° Elabora los óxidos a los siguientes elementos: Clasificálos en Óxidos Básicos u óxidos Ácidos
+3
+2
+3
+5
+6
+3
+7
+1
+2
+3
+6
+7
Mn + O2
ACTIVIDADES PARA RESOLVER EN CLASE
Hoy realizaremos la obtención de óxidos.........
No olvides llevar la bata y los demás implementos indispensables para tu seguridad.
Clase del 24 -09-15
Hola mis queridos estudiantes:
A continuación relaciono las actividades a realizar en casa:
Con los datos, la información y la explicación recibida en la clase anterior respecto a los indicadores de las funciones de la química mineral, responde:
consulta el PH de 20 sustancias que usas a diario y clasificalas en básicas o ácidas, organiza los datos en una tabla como la siguiente:
Sustancia
|
PH
|
Básica
|
Ácida
|
.
Para resolver en clase:
Anota las siguientes tablas sobre la formulación de óxidos :
Óxidos del grupo IA
Elemento
|
Valencia
|
Formula
|
N.1
|
N.2
|
N.3
|
Li
| |||||
Na
| |||||
K
| |||||
Rb
| |||||
Cs
| |||||
Fr
|
Óxidos del grupo IIA
Elemento
|
Valencia
|
Formula
|
N.1
|
N.2
|
N.3
|
Be
| |||||
Mg
| |||||
Ca
| |||||
Sr
| |||||
Ba
| |||||
Ra
|
Óxidos del grupo III A
Elemento
|
Valencia
|
Formula
|
N.1
|
N.2
|
N.3
|
B
| |||||
Al
| |||||
Ga
| |||||
In
| |||||
Tl
|
Oxidos del grupo IVA
Elemento
|
Valencia
|
Formula
|
N.1
|
N.2
|
N.3
|
C
| |||||
Si
| |||||
Ge
| |||||
Sn
| |||||
Pb
| |||||
Óxidos del grupo VA
Elemento
|
Valencia
|
Formula
|
N.1
|
N.2
|
N.3
|
N
| |||||
P
| |||||
As
| |||||
Sb
| |||||
Bi
| |||||
Óxidos del grupo VIA
Elemento
|
Valencia
|
Formula
|
N.1
|
N.2
|
N.3
|
S
| |||||
Se
| |||||
Te
| |||||
Po
| |||||
Óxidos del grupo VIIA
Elemento
|
Valencia
|
Formula
|
N.1
|
N.2
|
N.3
|
Cl
| |||||
Br
| |||||
I
| |||||
At
| |||||
Clase del 17 -09-15
Hola mis amiguitos, como están?
En la clase de hoy veremos:
1° Se entregaran las competencias del cuarto período.
2°Consigna en el cuaderno el siguiente mapa conceptual:
2°Consigue cada una de las sustancias solicitadas en la siguiente tabla.
Registra en el cuaderno la tabla para ser resuelta en clase:
Solicita a la docente tiras de papel tornasol. Impregna a cada sustancia y de acuerdo a la explicación de clasificalas según
su composición en Ácidas, Básicas o Neutras. Consulta su fórmula molecular y representa su estructura.
SUSTANCIA
|
CARACTER
|
FORMULA
|
PH
|
||
ACIDO
|
BASICO
|
NEUTRO
|
|||
Hidróxido de sodio
|
|||||
Bicarbonato de sodio
|
|||||
Vinagre
|
|||||
Jugo de naranja
|
|||||
Leche de Magnesia
|
|||||
Decol
|
|||||
Jabón
|
|||||
Orines
|
|||||
Jugo de limón
|
|||||
Alka seltzer
|
|||||
Hidróxido de sodio
|
|||||
Ácido nítrico
|
|||||
Clase del 10 -09-15
Actividades para resolver en casa:
1° Elaborar los enlaces de las moléculas pendientes por realizar en la clase del 03-09-15
2° Diseñar con creatividad la fórmula de lewis a las siguientes moléculas:
a) KCl
b) I2O
c) SO3
d) NO2
e) CO2
f) N2
g) H2O
h) Na2O
i) MgCl2
j) H2S
3° Estudiar para evaluación del tema de enlaces.
4° Copiar en el cuaderno o imprimir el siguiente formato y diligenciar la autoevaluación y coevaluación.
CRITERIO
|
AUTO
EVALUACION
|
COE
VALUACION
|
HETERO
EVALUACION
| |
1
|
Busco la excelencia en el desarrollo ypresentación de tareas y trabajos.
| |||
2
|
Asisto puntualmente a clase y recibo a la docente en mi respectivo puesto.
| |||
3
|
Presento buena disposición en clase, soy atento y participativo.
| |||
4
|
Me preparo con anterioridad en las evaluaciones programadas.
| |||
5
|
Mantengo buena disciplinadurante todala clase.
| |||
6
|
Respeto a compañeros ydocente.
| |||
7
|
Soy solidario con mis compañeros.
| |||
8
|
Acato las normas de presentación personal establecidas por la Institución.
| |||
9
|
Soy ordenado y aseado con mi entorno.
| |||
10
|
Cumplo oportunamente con las actividades extra clase.
| |||
TOTAL
|
Acciones de Mejora:
Acciones Correctivas:
Acciones Preventiva:
Clase del 03 -09-15
1° Resolver en clase las preguntas pendientes del taller de enlaces químicos: Ejercicios 5,6,7,8,y 9
2° Favor llevar a clase los siguientes materiales:
Lana de un solo color
Plastilina de tres colores
Medio pliego de cartón paja
1 marcador permanente
3° Representar los enlaces en las siguientes moléculas: Debes
ser bien creativo:
a) KCl
b) I2O
c) SO3
d) NO2
e) CO2
f) N2
g) H2O
h) Na2O
i) MgCl2
j) H2S
Clase del 27-08-15
Aprovecho para felicitarlos con un abrazo de oso giganteeeeeeeeee por el excelente compromiso mostrado en las olimpiadas del SABER.02
Niños(as) las actividades programadas para el 19-08 se realizarán en la clase del 20-08-15
Clase del 20-08-15
Los aplausos de hoy son para:
ANA SOFIA REYES, impecable su trabajo en clase.
JUAN JOSÉ NAVARRO por mejorar la atención y el trabajo en clase
JHON ALEXANDER CARTAGENA por su excelente disciplina y en especial por el gusto que demuestra en la realización de las actividades propuestas para la clase
ACTIVIDADES A DESARROLLAR EN CLASE:
Orientados por la educadora.
Orientados por la educadora.
1° Observar el siguiente vídeo:
2° Resolver el siguiente taller de ENLACES QUÍMICOS organizados en grupos de dos estudiantes. Cada estudiante debe traerlo impreso o copiado en el cuaderno. Gracias.
TALLER DE
ENLACES QUÍMICOS
1. Haz
una tabla comparativa con las características del enlace covalente y del enlace
iónico teniendo en cuenta lo siguiente:
a.
¿Cómo se forma?
b.
¿Qué compuestos lo presentan?
c.
Propiedades de los compuestos
con este tipo de enlace
2. Definir
los siguientes términos:
a. Enlace
químico
b. Valencia
c. Regla
del octeto
d. Electronegatividad
3. Dos
compuestos, A y B, tienen las siguientes propiedades:
Compuesto A
|
Compuesto B
|
|
Estado físico
|
Sólido
|
Sólido
|
Punto de fusión
|
346 ºC
|
1196 ºC
|
Solubilidad en agua
|
Soluble
|
Soluble
|
Conductividad eléctrica en solución
|
No
|
Sí
|
¿Cuál de los dos compuestos
será más posiblemente iónico y por qué?
4. Con
base en los valores de electronegatividad indicar si los siguientes pares de
elementos forman enlaces iónicos o covalentes (polar o no polar)
N-H
|
Ca-F
|
Br-Cl
|
O-P
|
Cu-O
|
S-O
|
O-Na
|
C-P
|
H-S
|
Ba-N
|
O-H
|
I-I
|
Li-F
|
C-S
|
Cs-Br
|
5. Utiliza
la estructura de Lewis para representar las moléculas de los siguientes
compuestos:
CH4
|
Cl2O
|
SiCl4
|
ClO3─
|
PCl3
|
HClO3
|
NO2+
|
PCl6─
|
HClO
|
HCO3─
|
Na2SO4
|
NH4Cl
|
6. En
cuál de las siguientes fórmulas hay enlace covalente coordinado o dativo
AlF3
C2H2 SO2 H3O+
7. Usando
el concepto de valencia para los elementos S, P y Br predice las fórmulas de
los compuestos más simples formados por estos elementos al combinarse, cada
uno, con el hidrógeno
8. ¿Qué
tipo de enlace se formará entre las siguientes parejas de elementos y cuál
sería la fórmula del compuesto que se formaría?
P y O
|
N y Ba
|
N y Te
|
F y O
|
9. Indica
si es posible un enlace iónico entre los siguientes pares de elementos y
esquematiza cada uno
K-N
|
F-Zn
|
F-Na
|
Mg-O
|
Cl-Br
|
K-O
|
K-Ca
|
Cl-Ca
|
Cl-O
|
Na-Ca
|
10. De
los siguientes compuestos, ¿cuáles no cumplen la ley del octeto?
Justifique su respuesta
PCl5
AlBr3
CCl4
VALORES DE ELECTRONEGATIVIDAD SEGÚN LA ESCALA DE
PAULING DE ALGUNOS ELEMENTOS
11. Teniendo en cuenta
que los valores de la electronegatividad según la escala de Pauling de los
elementos siguientes son: H: 2,1 ; O: 3,5 ; Na: 0,9 ; S: 2,5 y Cl: 3,0 ¿Cual de
los siguientes enlaces es más polar?
A. H-O
B . H-Na
C .
H-S D. H-Cl
12. Los tipos de
enlace que pueden darse entre dos átomos pueden ser:
A. Iónico y covalente.
B. Iónico, covalente y
metálico.
C. Iónico, covalente,
metálico y por fuerzas de Van der Waals.
D. Iónico, covalente,
metálico, por fuerzas de Van der Waals y por puente de hidrógeno.
13. En las reacciones
químicas, las partículas de los átomos que interactúan para producir nuevas
sustancias son
A. los electrones que
hay en el núcleo.
B. los protones del
último nivel de energía.
C. los neutrones de
los orbitales enlazados.
D. los electrones de
valencia.
14. ¿En cuál de los
compuestos siguientes tiene un enlace fundamentalmente iónico?
A. H 2 O
B. C Cl 4
C. BeH 2
D. NaI
15. Indicar la
afirmación correcta basándose en la tabla de electronegatividad de los
elementos, en cuanto al tipo de enlace que se formará entre los elementos que
se indican:
A. El Ca y el O forman
un enlace covalente polar
B. El H y el Cl forman
un enlace iónico
C. El K y el F forman
un enlace iónico
D. El H y en Br forman
un enlace covalente apolar
16. Indique la
afirmación correcta, basándose en la electronegatividad de los elementos
señalados: “Se formará entre ...
A. El Ca y el O un
enlace parcialmente covalente o covalente polar
B. El H y el Cl un
enlace iónico
C. El K y el F un
enlace iónico
D. El H y el Br un
enlace covalente puro o apolar
17. De los compuestos
que a continuación se indican, es preferentemente iónico el:
A. C Cl 4
B. BeH 2
C.
KBr
D. H 2 O
18. Dada la
configuración electrónica de un elemento 1 s2 2s2 2p6 3s2 3p6 3d10 4s1deducir
si tenderá a formar:
A. enlace iónico y
covalente;
B. enlace iónico y
metálico;
C. enlace metálico y
covalente
D. ninguna de la
anteriores
19. Para que entre dos
átomos exista un enlace iónico:
A. Ambos deben tener
una electronegatividad semejante.
B. Uno debe tener una
afinidad electrónica alta y otro un potencial de ionización baja.
C. Uno de ellos debe
tener una electroafinidad alta y el otro, debe tener una energía de ionización
alta.
D. Solamente puede
darse entre un halogeno y un alcalino.
20. El FLUOR (Z =19) y
el SODIO (Z = 11) se unen dando un compuesto del cual podemos decir que se forma:
A. Por transferencia
de un electrón de cada átomo de sodio a cada átomo de flúor.
B. Por transferencia
de dos electrones de cada átomo de sodio a cada átomo de flúor
C. Por compartición de
un par de electrones procedentes uno del átomo de sodio y otro del átomo de
flúor.
D. Por compartición de
dos electrones procedentes ambos del átomo de sodio.
21. Indica cuál de los
siguientes compuestos es iónico:
A. HCl
B.
NaBr C.
CS 2
D. N 2 O
22. Entre los siguientes
compuestos, señala aquel cuyos enlaces presenten un mayor carácter iónico:
A. RbCl
B.
NaI
C. MgO
D. CsF
23. Señala cuál de los
siguientes compuestos no es iónico:
A. Ag 2 SO 4 B.
CuCl 2 C.
HCl
D. Na 2 S
24. Para que dos
átomos "A" y "B" se unan mediante un enlace iónico es
necesario que:
A. La afinidad
electrónica del elemento menos electronegativo sea muy elevada.
B. Que se transfieran
electrones del elemento más electronegativo al menos electronegativo.
C. Que la
electronegatividad de ambos elementos sea muy diferente.
D. Que el tamaño de
los átomos que van a enlazarse sea similar.
No olviden desarrollar en casa los ejercicios 2 y 3 pendientes por resolver publicado en la clase del 06-08.
En clase se revisará la consulta del punto de fusión, ebullición y densidad de las sustancias empleadas en la práctica de laboratorio de la clase del 13-08.
FELICIDADES ANA SOFIA POR EL INTERES Y GANAS EN BUSCAR LA EXCELENCIA.
CLASE DEL 13-08-15
Práctica de laboratorio:
Llevar pequeñas canidades de las siguientes sustancias:
Jugo de limon
Leche de magnesia
Decol
Vinagre
Alcohol
Bicarbonato de sodio
Sal
Azúcar
Jugo de naranja
No olvides llevar la bata, guantes y demas material de seguridad para la prácica de laboratorio.
Los cuadernos los entrego el mismo día de clase.
Clase del 6-08-15
Para resolver en casa:
Observa la siguiente imagen y resuelve:
FIGURA A FIGURA B
Observa los siguientes modelos atómicos y resuelve:
Figura A:
|
Elemento
|
Símbolo
|
A
|
Z
|
P+
|
e-
|
no
|
D.electronica
|
Figura B
|
Elemento
|
Símbolo
|
A
|
Z
|
P+
|
e-
|
no
|
D.electronica
|
De acuerdo a lo observado que compuesto químico se forma de dicha unión? Escribe su fórmula molecular y estructural.
Que elemento gana electrones? Por qué?
Que elemento pierde electrones? Por qué?
Por qué se enlazan los átomos?
Que se forma de dicha unión?
Actividad para resolver en clase:
Favor copiar en el cuaderno:
Resolver en clase:
Parejas
de elementos
|
Valor
de electronegatividad
|
Diferencia
de electronegatividad
|
Tipo
de enlace
|
Cl -
O
|
|||
S –C
|
|||
H
–Cl
|
|||
Na y
O
|
|||
Mg -
I
|
|||
P-H
|
|||
S-O
|
|||
N-O
|
|||
Br-Br
|
|||
Ca y
Cl
|
A.
Escribe la fórmula de Lewis a cada pareja de
elementos del ejercicio anterior, para ello consulta el número de electrones de
valencia (según el grupo al que pertenezca) y escríbelo con puntos o circes
alrededor del símbolo del elemento, así:
Ej.: Ca: Grupo II A por lo tanto tiene dos
electrones de valencia. **Ca
Parejas
de elementos
|
Número
del grupo
|
Numero
de e- de valencia
|
Formula
de Lewis
|
Cl
|
|||
O
|
|||
S
|
|||
C
|
|||
H
|
|||
Cl
|
|||
Na
|
|||
O
|
|||
Mg
|
|||
I
|
|||
P
|
|||
H
|
|||
S
|
|||
O
|
|||
N
|
|||
O
|
|||
Br
|
|||
Br
|
|||
Ca
|
|||
Cl
|
Realiza el mismo ejercicio del punto anterior con el siguiente listado de parejas de elementos:
a. Li y I
b. Ca y Se
c. H yCl
d. Na y O
e. Rb y Se
f. Li y H
g. Na y S
h. H y O
i. C y O
j. Ba y Br
k. Li y F
La siguiente actividad solo la deben desarrollar y estudiar para sustentación los dos jóvenes que en clase se les indicó dicha actividad.
Clase del 30-07-15
Hola mis queridos estudiantes.
El PC de mi portátil sufrió serios daños........ pero tranquilos que ya todo se solucionó, así que manos a la obra.
No olvides llevar a la clase la tabla periódica terminada, junto con las fichas que tienen el nombre de cada elemento.
Haz un repaso a las reglas vistas en clase respecto a los símbolos de los elementos.
HOLA MIS EXPERIMENTORES. MIL DISCULPAS. CREO QUE ME ATACO EL VIRUS DEL ZICA. MI CUERPO NO SE SENTÍA PARA NADA BIEN. MUCHACHOS PROTEJANSEN LO NECESARIO, POR QUE ESTA ENFERMEDAD GENERA MUCHO DOLOR Y MALESTAR.
LO PROGRAMADO PARA EL 15-07, LO DESARROLLAREMOS EN LA CLASE DE LA PRÓXIMA SEMANA. RECIBO FRUTAS.......JAJAJA
Clase del 16-07-15
Hola mis queridos experimentores:
No olvides llevar el material solicitado para la clase del 8-07.
Sigue reforzando el tema de Tabla periódica, ya que constantemente se estarán haciendo preguntas.
Anota en el cuaderno el siguiente mapa conceptual que será explicado en clase.
En clase vamos a resolver el siguiente taller, por favor llévalo copiado en el cuaderno:
1. Clasifica los siguientes elementos en: Metal alcalino, metal
alcalinotérreo, metal de transición, metaloide, no metal, halógeno, gas noble,
región s, región p, región d, región f,
lantánido y actínido.
a.
Aluminio
b.
Azufre
c.
Calcio
d.
Cerio
e.
Einstenio
f.
Escandio
g.
Flúor
h.
Francio
i.
Germanio
j.
Hidrógeno
k.
Hierro
l.
Indio
m.
Kriptón
n.
Neodimio
o.
Neón
p.
Oxigeno
q.
Potasio
r.
Radón
s.
Yodo
t.
Zinc
u.
Zirconio
2.
Indica
el grupo, el periodo y la región en el que se encuentran los siguientes
elementos. Realiza la configuración electrónica para cada uno.
a.
Al
b.
B
c.
Br
d.
C
e.
Ca
f.
Cl
g.
Fe
h.
Ge
i.
H
j.
Hg
k.
Ne
l.
Pd
m.
Sn
Para resolver en casa:
Con
la ayuda de la tabla Periódica resolver:
Cuantos
y que elementos pertenecen a los 7 periodos
de la tabla Periódica?
Cuantos
y que elementos pertenecen a los grupos A y B de la tabla Periódica?
2° Indique el periodo y grupo a los siguientes elementos químicos:
Aluminio
Z: 13
Níquel
Z: 28
Flúor
Z: 9
Escandio
Z: 21
Bromo
Z: 35
Cesio
Z: 55
Zinc
Z: 30
Argón
Z: 18
3°
Efectúe la distribución electrónica a cada uno de los electos que pertenecen a los grupos: IA, IIA, IIIA, IVA, VA, VIA y VIIA. Diga una conclusión a cada grupo, después de efectuada la distribución.
5°
Elabore el croquis de la tabla periódica, e identifique un ejemplo de
Regiones S, P, D, y F
Elementos
representativos y elementos de transición.
Elementos
sólidos, líquidos y gaseosos.
Elementos
metálicos, no metálicos y metaloides.
Familias alcalino, alcalinotérreos, del boro, del nitrógeno, del carbono, anfígenos, halógenos y gases nobles
Clase del 8-07-15
Hoy jugaremos con la Tabla Periódica: Ingresa a los siguientes link
http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/tabla_period/tabla4.htm
http://www.quimitris.com/index.phphttp://www.quimitris.com/index.php
Lleva a clase:
1 paquete de memofichas
La tabla periódica
Marcadores de colores
1 pliego de papel craf
Regla
HOLA DE NUEVO
LOS ESPERO EN CLASE RECARGADOS DE MUCHAAAA ENERGIA Y ALEGRIA POR APRENDER COSAS NUEVAS......
UNAS MERECIDAS VACACIONES...
UN HASTA LUEGO. SIEMPRE TE RECORDAREMOS. EXITOS EN TU NUEVO AMBIENTE ESCOLAR.....
Clase del 10 de junio
1° Copiar en el cuaderno o imprimir el siguiente formato, para diligenciarlo en clase, atendiendo las pautas de la educadora:
CRITERIO
|
AUTO
EVALUACION
|
COE
VALUACION
|
HETERO
EVALUACION
| |
1
|
Busco la excelencia en el desarrollo y presentación de tareas y trabajos.
| |||
2
|
Asisto puntualmente a clase y recibo a la docente en mi respectivo puesto.
| |||
3
|
Presento buena disposición en clase, soy atento y participativo.
| |||
4
|
Me preparo con anterioridad en las evaluaciones programadas.
| |||
5
|
Mantengo buena disciplina durante toda la clase.
| |||
6
|
Respeto a compañeros y docente.
| |||
7
|
Soy solidario con mis compañeros.
| |||
8
|
Acato las normas de presentación personal establecidas por la Institución.
| |||
9
|
Soy ordenado y aseado con mi entorno.
| |||
10
|
Cumplo oportunamente con las actividades extra clase.
| |||
TOTAL
|
Acciones de Mejora:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Acciones Correctivas:
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Prepárate desde casa para la
evaluación del átomo, entrando a los siguientes link e
interactuando con las actividades allí propuestas.
Resuelve
las siguientes preguntas:
1° Los isotopos más
estables del azufre son:Halle la masa atómica promedio del Azufre.
ELEMENTO
U.M.A % DE
ABUNDNACIA
S
32
95%
S
33
1%
S
34
4%
2° Completa
la siguiente información:
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
3° Compara los modelos atómicos de Daltón, Thomson, y rutherford y escribe cinco diferencias:
Modelo Atómico de Dalton
|
Modelo Atómico de Thomson
|
Modelo Atómico de Rutherford
|
4.
Realiza la distribución electrónica y por orbitales a los siguientes atomos:
Sodio
Oxígeno
Neón
Calcio
Bromo
Potasio
Sodio
Oxígeno
Neón
Calcio
Bromo
Potasio
5. Define los siguientes términos:
Electrón
Protón
Neutrón
Número Atómico
Masa Atomica
Nivel
Subnivel
Orbit
Electrón
Protón
Neutrón
Número Atómico
Masa Atomica
Nivel
Subnivel
Orbit
6°
Determine masa atómica, numero atómico, neutrones, electrones
Elemento
|
Z
|
A
|
N
|
E
|
Li
|
3
|
4
|
||
N
|
14
|
7
|
||
F
|
9
|
19
|
||
B
|
5
|
6
|
.jpg)






























hola profe, le tenia una pequeña pregunta que hay que completar en lo de las imágenes de los átomos en el 2. punto ??? no entendí :( ese punto
ResponderEliminarEl nombre del autor, indicando las características de cada modelo. Gracias por visitar el blog.
ResponderEliminarprofe perdone por no entregar el átomo yo lo hice pero se me olvido llevarlo porque es tuve donde mi tia y cuando llegue ami casa se me quedo hasta el jueves y no lo pude entregar el miércoles te lo llevo si :D
ResponderEliminar:( :(
me gusto mucho la pelicula porque fue de mucha accion grandes explosiones, mucha agua y el barco del general exploto y los barcos que se transformaba y las armas atte roy
ResponderEliminarGracias por visitar el blog. El mensaje del autor hace referencia entre otros a valorar y respetar los recursos naturales.
EliminarLa película me gusto mucho ya que me ayudó a distraerme,aunque me generó un gran impacto, me sorprendí cuando vi los pocos recursos naturales que les quedaban, esta película también nos sirve de advertencia para que nos demos cuenta de todo el daño que le hacemos al planeta.
ResponderEliminarGracias por tu visita al blog. Realmente somos testigos de esa realidad, en nuestras manos esta el cambio.
EliminarHola profe Astrid te escribia para ver como podia arreglar las notas pendientes gracias.
ResponderEliminarResuelve el taller que se publico para nivelar y mejorar las notas. Lo estudias y presentas el 18-11-15.
ResponderEliminarLucky Club Casino site
ResponderEliminarLucky Club Casino review – including real players' reviews and feedback. Lucky club. luckyclub Live casino · Lucky Club casino login details. More casinos. Play responsibly. Rating: 4 · Review by LuckyClub.live